

YFX-CLR007
1×106cells/T25培养瓶
1550
|
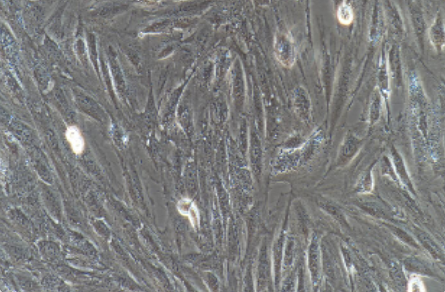
细胞简介 |
B. Kimes and B. Brandt从源于BD1X大鼠胚胎心脏组织的克隆细胞株亚克隆了H9c2(2-1)细胞株,它表现许多骨骼肌的特性。这个细胞株中的成肌细胞能融合形成多核的肌管,并对乙酰胆碱的刺激发生反应。如果培养基中的血清浓度下降到1%,融合发生得很快。 |
|
生长培养基 |
DMEM-H+10% FBS+1% P/S |
|
细胞特性 |
成肌细胞样,贴壁生长 |
|
培养条件 |
气相:空气,95%;二氧化碳,5%。 温度:37℃,培养箱湿度为70%-80%。 |
|
推荐传代比例 |
1:2-1:4 |
|
推荐换液频率 |
2~3次/周 |
|
冻存条件 |
冻存液:90%血清,10%DMSO,现用现配。 |
|
运输 |
冻存细胞干冰运输; 复苏细胞常温运输。 |
1、收到常温细胞后,第一时间检查培养瓶有无漏液、瓶身有无破损现象,如有则立即拍照并联系公司业务员;收到冻存细胞后,第一时间检查干冰是否全部已挥发、冻存管瓶盖是否脱落、破损,如有则立即拍照并联系公司业务员。
2、不要打开培养瓶盖,先用75%酒精擦拭培养瓶表面,显微镜下观察细胞状态,如有任何疑问,立即拍照清晰照片,联系公司业务员。
3、将细胞静置于细胞培养箱培养2-4小时,稳定细胞状态。
4、仔细阅读说明书,严格按照说明书上的要求进行后续操作。
5、静置完成后,取出细胞培养瓶,进行镜检、拍照(建议40×、100×、200×各一张),所拍照片将作为后续服务的依据,建议细胞传代培养之后,定期拍照、记录细胞生长状态。
一、悬浮细胞:
可通过补充新鲜培养基或者离心换液两种方式维持培养,离心转速参考1200 rpm(250g左右),离心3分钟。
二、贴壁细胞:
1、弃去培养上清,用不含钙、镁离子的 PBS 润洗细胞 1-2 次。
2、 加入 0.25%(w / v)胰蛋白酶-0.53 mM EDTA 于培养瓶中(T25 瓶 1-2mL,T75 瓶 2-3mL),置于 37℃培养箱中消化 1-2 分钟(难消化的细胞可以适当延长消化时间),然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加入 3-4mL 含 10%FBS 的培养基来终止消化。
3、轻轻打匀后吸出,在 1000RPM 条件下离心 3-5min,弃去上清液,补加 1-2mL培养液后吹匀。将细胞悬液按 1:2 的比例分到新 T25 瓶中,添加 6-8mL 按照说明书要求配置的新的完全培养基以保持细胞的生长活力,后续传代根据实际情况按 1:2~1:5 的比例进行。
将含有 1mL 细胞悬液的冻存管在 37℃水浴中迅速摇晃解冻,加入到含 4-6mL 完全培养基的离心管中混合均匀。在 1000RPM 条件下离心 3-5min,弃去上清液,完全培养基重悬细胞。然后将细胞悬液加入含 6-8mL 完全培养基的培养瓶(或皿)中 37℃培养过夜。第二天显微镜下观察细胞生长情况和细胞密度。
收到细胞后建议在培养前 3 代时冻存一批细胞种子以备后续实验使用。下面 T25 瓶为例:
1、细胞冻存时按照细胞传代的过程收集消化好的细胞到离心管中,可使用血球计数板计数,来决定细胞的冻存密度。一般细胞的推荐冻存密度为 1×106~1×107个活细胞/mL。
2、1000rpm 离心 3-5min,去掉上清。用配制好的细胞冻存液重悬细胞 ,按每1mL 冻存液含 1×106~1×107个活细胞/mL 分配到一个冻存管中将细胞分配到冻存管中,标注好名称、代数、日期等信息。
3、将要冻存的细胞置于程序降温盒中,-80 度冰箱中过夜,之后转入液氮容器中储存。同时记录好冻存管在液氮容器中的位置以便后续查阅和使用。

